Sonder la mécanique des tissus biologiques en utilisant leurs propres cellules comme actuateurs
Recherche
le 28 février 2023

En combinant ingénierie tissulaire et optogénétique, des biophysiciens du Laboratoire Interdisciplinaire de Physique de Grenoble (Liphy - CNRS / UGA) ont transformé des cellules en micro-actuateurs biologiques afin d'étudier la propagation spatio-temporelle des signaux mécaniques dans les tissus biologiques et de caractériser l'architecture et les propriétés viscoélastiques de ces tissus. Ce résultat de recherche a fait l'objet d'une publication dans Nature communications le 9 février 2023.
In vivo, les cellules appliquent des forces sur leur environnement afin de se déplacer, de se diviser ou de modifier cet environnement, mais aussi pour communiquer et se coordonner avec leurs voisines à longue distance. Dans les approches standards, l'exploration de ces mécanismes se fait par le biais d'actuations mécaniques externes qui visent à imiter ces signaux mécaniques. Toutefois, il reste difficile d'évaluer comment ces stimuli externes se comparent aux contractions que les cellules exercent spontanément. Par ailleurs, des traitements biochimiques permettent de moduler les processus cellulaires responsables de ces signaux, mais leur incapacité à cibler des zones de tissus définies dans l'espace et leur faible résolution temporelle, limitent fortement leur potentiel. Dans cet article, une nouvelle approche est proposée afin d'élucider comment les forces cellulaires sont générées, propagées et détectées dans les tissus physiologiques et pathologiques.
Des biophysiciens du Laboratoire Interdisciplinaire de Physique de Grenoble (Liphy - CNRS / UGA) ont cherché à sonder les propriétés mécaniques des tissus biologiques "de l'intérieur", comme le font naturellement les cellules. Pour cela, ils ont combiné ingénierie tissulaire et optogénétique. L'ingénierie tissulaire leur a permis de générer des microtissus tridimensionnels, composés de fibroblastes encapsulés dans du collagène, suspendus entre deux micropiliers dont la déflexion permet de suivre la tension tissulaire en temps réel. L'approche optogénétique consiste à modifier génétiquement les fibroblastes afin de contrôler par la lumière l'activité d'un régulateur majeur de leur contractilité. Grâce à la résolution spatiale et temporelle des stimulations lumineuses, ils ont induit des contractions locales dans ces microtissus, tout en mesurant les déformations en résultant. Ils ont ainsi quantifié les propriétés viscoélastiques de ces microtissus, du "point de vue" des cellules, et ont démontré le potentiel de cette approche pour quantifier l'impact du collagène ou de l'initiation d'une fibrose sur l'élasticité tissulaire. La possibilité d'illuminer seulement une partie du tissu leur a permis de cartographier les anisotropies locales dans des microtissus hétérogènes et d'influencer la formation de ces tissus.
Ces résultats ouvrent la voie au contrôle spatio-temporel de la formation de tissus tout en cartographiant de manière non destructive leur rhéologie en temps réel, en utilisant leurs propres cellules constitutives comme actionneurs internes.
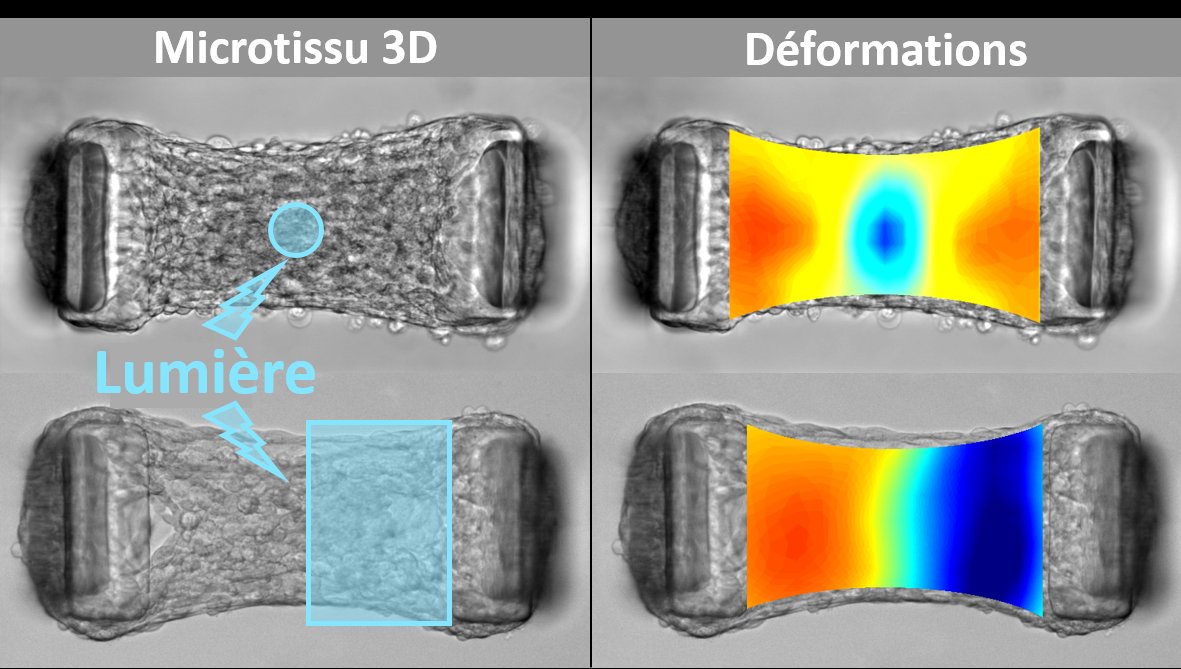
Des biophysiciens du Laboratoire Interdisciplinaire de Physique de Grenoble (Liphy - CNRS / UGA) ont cherché à sonder les propriétés mécaniques des tissus biologiques "de l'intérieur", comme le font naturellement les cellules. Pour cela, ils ont combiné ingénierie tissulaire et optogénétique. L'ingénierie tissulaire leur a permis de générer des microtissus tridimensionnels, composés de fibroblastes encapsulés dans du collagène, suspendus entre deux micropiliers dont la déflexion permet de suivre la tension tissulaire en temps réel. L'approche optogénétique consiste à modifier génétiquement les fibroblastes afin de contrôler par la lumière l'activité d'un régulateur majeur de leur contractilité. Grâce à la résolution spatiale et temporelle des stimulations lumineuses, ils ont induit des contractions locales dans ces microtissus, tout en mesurant les déformations en résultant. Ils ont ainsi quantifié les propriétés viscoélastiques de ces microtissus, du "point de vue" des cellules, et ont démontré le potentiel de cette approche pour quantifier l'impact du collagène ou de l'initiation d'une fibrose sur l'élasticité tissulaire. La possibilité d'illuminer seulement une partie du tissu leur a permis de cartographier les anisotropies locales dans des microtissus hétérogènes et d'influencer la formation de ces tissus.
Ces résultats ouvrent la voie au contrôle spatio-temporel de la formation de tissus tout en cartographiant de manière non destructive leur rhéologie en temps réel, en utilisant leurs propres cellules constitutives comme actionneurs internes.

Contractions locales induites par des motifs de lumière (symbolisés en bleu) dans des microtissus 3D modifiés par optogénétique. Les microtissus, de taille caractéristique 0.5 mm, sont composés de fibroblastes encapsulés dans du collagène.
Publié le 28 février 2023
Mis à jour le 28 février 2023
Mis à jour le 28 février 2023
Références
Méry A, Ruppel A, Revilloud J, Balland M, Cappello G & Boudou T. Light-driven biological actuators to probe the rheology of 3D microtissues.
Nat. Commun.14, 717 (2023). doi:10.1038/s41467-023-36371-w
Nat. Commun.14, 717 (2023). doi:10.1038/s41467-023-36371-w

