L’astrocyte en première ligne dans le déclenchement de la maladie d’Alzheimer
Recherche
le 30 août 2021
Les astrocytes ont longtemps été considérés comme de simples cellules de soutien des neurones. Depuis quelques années, leur importance dans le fonctionnement du cerveau et la pathogenèse de maladies neurodégénératives est peu à peu mise à
jour. Des chercheurs de l’Université Grenoble Alpes au Grenoble Institut des Neurosciences (UGA/INSERM/CHU/CEA/CNRS) ont révélé le rôle crucial de ces cellules dans la mise en place de la toxicité du peptide amyloïde-bêta responsable de la maladie
d’Alzheimer. Ces travaux ont été publiés dans la revue Brain.
Via leurs interactions avec les neurones, les astrocytes sont en première ligne dans la mise en place des évènements conduisant à une toxicité neuronale irréversible. L’inhibition du canal TRPA1 astrocytaire permet de prévenir la mise en place de cette toxicité à des stades précoces de la maladie et d’empêcher l’installation d’un cercle vicieux conduisant à une neurodégénérescence irréversible. Ces travaux mettent l’astrocyte au cœur des acteurs de la pathogénie de la maladie d’Alzheimer et permettent d’envisager de nouvelles stratégies thérapeutiques préventives à l’heure où les méthodes diagnostiques évoluent pour devenir de plus en plus précoce.
La prise en charge de la maladie d'Alzheimer se heurte à un échec récurrent des stratégies thérapeutiques mises en place. Une intervention précoce, durant la phase prodromale, semble indispensable pour offrir un nouvel espoir aux patients. Récemment, il a été montré chez l’Homme qu'une hyperactivité précoce des circuits neuronaux de l'hippocampe est responsable de déficits mnésiques prodromaux non invalidants mais précurseurs de la maladie d'Alzheimer [1]. Les astrocytes sont maintenant connus pour jouer un rôle majeur dans l'intégrité de l'activité des neurones notamment via leurs prolongements qui enrobent la plupart des synapses et modulent leur fonctionnement. De précédentes recherches ont révélé que ces astrocytes sont en première ligne dans la mise en place de l'hyperactivité neuronale hippocampique dans un modèle murin de maladie d'Alzheimer. Les chercheurs ont mis en évidence que cette hyperactivité neuronale est une étape critique dans la progression de la maladie d'Alzheimer et présage de la survenue d’une hypoactivité puis d’une mort neuronale. Elle est initiée par une hyperactivité astrocytaire responsable de la libération de gliotransmetteurs excitateurs. Le canal calcique astrocytaire (TRPA1) semble impliqué dans cette toxicité précoce et son inhibition bloque l'hyperactivité neuronale ouvrant ainsi la voie à une nouvelle stratégie thérapeutique potentielle.
Afin de tester cette hypothèse, les chercheurs ont testé les effets à court, moyen et long terme d’un traitement pharmacologique chronique avec un inhibiteur de TRPA1 sur un modèle murin de la maladie d’Alzheimer. Ils ont analysé l’activité fonctionnelle des astrocytes et des neurones au sein de l’hippocampe et ont montré que l’inhibition pharmacologique de TRPA1 empêche la survenue des déficits fonctionnels astrocytaires et neuronaux à court et moyen terme. Au niveau structural, la structure des épines dendritiques n’est plus altérée par la progression de la pathologie et l’enrobage astrocytaire des synapses est préservé.
A plus long terme, les chercheurs ont montré à travers des tests comportementaux que le traitement des animaux par l’inhibiteur de TRPA1 permet de restaurer les déficits mnésiques dans ce modèle murin de la maladie d’Alzheimer en normalisant les performances de mémoire spatiale classiquement altérées par la pathologie. Ce traitement participe également à restreindre la toxicité du peptide amyloïde-β en augmentant sa compaction dans les plaques séniles.
Il semble donc qu’il existe une fenêtre critique dans le développement de la maladie d’Alzheimer au cours de laquelle il est encore possible de réverser la toxicité neuronale du peptide amyloïde-β. L’astrocyte est au cœur de la mise en place de cette toxicité qui se répercute sur la fonction neuronale à travers la perturbation des interactions astrocyte-neurone. L’inhibition de cette fenêtre critique en ciblant l’activité astrocytaire s’opère au niveau fonctionnel mais également structural et semble suffisante pour empêcher l’entrée dans un cercle vicieux délétère.
La prise en charge de la maladie d'Alzheimer se heurte à un échec récurrent des stratégies thérapeutiques mises en place. Une intervention précoce, durant la phase prodromale, semble indispensable pour offrir un nouvel espoir aux patients. Récemment, il a été montré chez l’Homme qu'une hyperactivité précoce des circuits neuronaux de l'hippocampe est responsable de déficits mnésiques prodromaux non invalidants mais précurseurs de la maladie d'Alzheimer [1]. Les astrocytes sont maintenant connus pour jouer un rôle majeur dans l'intégrité de l'activité des neurones notamment via leurs prolongements qui enrobent la plupart des synapses et modulent leur fonctionnement. De précédentes recherches ont révélé que ces astrocytes sont en première ligne dans la mise en place de l'hyperactivité neuronale hippocampique dans un modèle murin de maladie d'Alzheimer. Les chercheurs ont mis en évidence que cette hyperactivité neuronale est une étape critique dans la progression de la maladie d'Alzheimer et présage de la survenue d’une hypoactivité puis d’une mort neuronale. Elle est initiée par une hyperactivité astrocytaire responsable de la libération de gliotransmetteurs excitateurs. Le canal calcique astrocytaire (TRPA1) semble impliqué dans cette toxicité précoce et son inhibition bloque l'hyperactivité neuronale ouvrant ainsi la voie à une nouvelle stratégie thérapeutique potentielle.
Afin de tester cette hypothèse, les chercheurs ont testé les effets à court, moyen et long terme d’un traitement pharmacologique chronique avec un inhibiteur de TRPA1 sur un modèle murin de la maladie d’Alzheimer. Ils ont analysé l’activité fonctionnelle des astrocytes et des neurones au sein de l’hippocampe et ont montré que l’inhibition pharmacologique de TRPA1 empêche la survenue des déficits fonctionnels astrocytaires et neuronaux à court et moyen terme. Au niveau structural, la structure des épines dendritiques n’est plus altérée par la progression de la pathologie et l’enrobage astrocytaire des synapses est préservé.
A plus long terme, les chercheurs ont montré à travers des tests comportementaux que le traitement des animaux par l’inhibiteur de TRPA1 permet de restaurer les déficits mnésiques dans ce modèle murin de la maladie d’Alzheimer en normalisant les performances de mémoire spatiale classiquement altérées par la pathologie. Ce traitement participe également à restreindre la toxicité du peptide amyloïde-β en augmentant sa compaction dans les plaques séniles.
Il semble donc qu’il existe une fenêtre critique dans le développement de la maladie d’Alzheimer au cours de laquelle il est encore possible de réverser la toxicité neuronale du peptide amyloïde-β. L’astrocyte est au cœur de la mise en place de cette toxicité qui se répercute sur la fonction neuronale à travers la perturbation des interactions astrocyte-neurone. L’inhibition de cette fenêtre critique en ciblant l’activité astrocytaire s’opère au niveau fonctionnel mais également structural et semble suffisante pour empêcher l’entrée dans un cercle vicieux délétère.

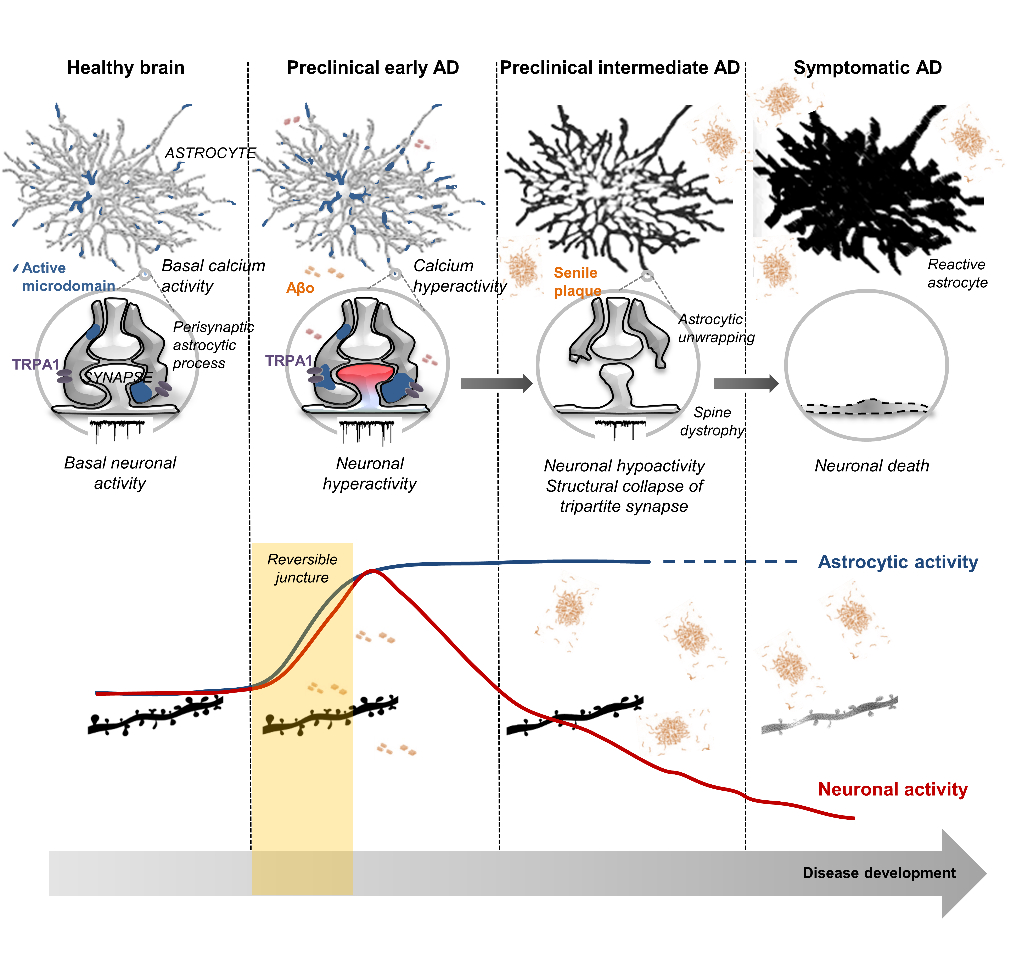
Figure 1 : Implication potentielle des astrocytes dans la régulation de l'activité neuronale au cours des premiers stades de la maladie d'Alzheimer et dans la progression vers des phases critiques irréversibles. En condition physiologique, les astrocytes présentent une activité calcique spontanée qui contribue à maintenir l'intégrité structurelle et fonctionnelle de la synapse (microdomaines actifs en bleu). Dans les premiers stades de la maladie d'Alzheimer, la présence du peptide amyloïde-β (Aβ) perturbe le fonctionnement physiologique de l'astrocyte. Par un effet d'activation du canal calcique TRPA1, l'astrocyte devient hyperactif et libère des gliotransmetteurs qui induisent une hyperactivité des neurones voisins. Ces phénomènes se combinent pour produire une toxicité synaptique (hypoactivité neuronale, effondrement morphologique des épines dendritiques, désenrobage astrocytaire, etc.) préludes aux troubles de la mémoire et à la mort neuronale (maladie d'Alzheimer symptomatique). Le blocage des événements initiaux par un inhibiteur de TRPA1 semble être suffisant pour prévenir le cercle vicieux de la neurodégénérescence de la maladie d'Alzheimer.
Publié le 30 août 2021
Mis à jour le 30 août 2021
Mis à jour le 30 août 2021
Contact chercheur
Références
Astrocyte-neuron interplay is critical for Alzheimer's disease pathogenesis and is rescued by TRPA1 channel blockade
Adrien Paumier, Sylvie Boisseau, Muriel Jacquier-Sarlin, Karin Pernet-Gallay, Alain Buisson, Mireille Albrieux
DOI: 10.1093/brain/awab281
Adrien Paumier, Sylvie Boisseau, Muriel Jacquier-Sarlin, Karin Pernet-Gallay, Alain Buisson, Mireille Albrieux
DOI: 10.1093/brain/awab281

