Références
Substrate-bound and substrate-free outward-facing structures of a multidrug ABC exporter.
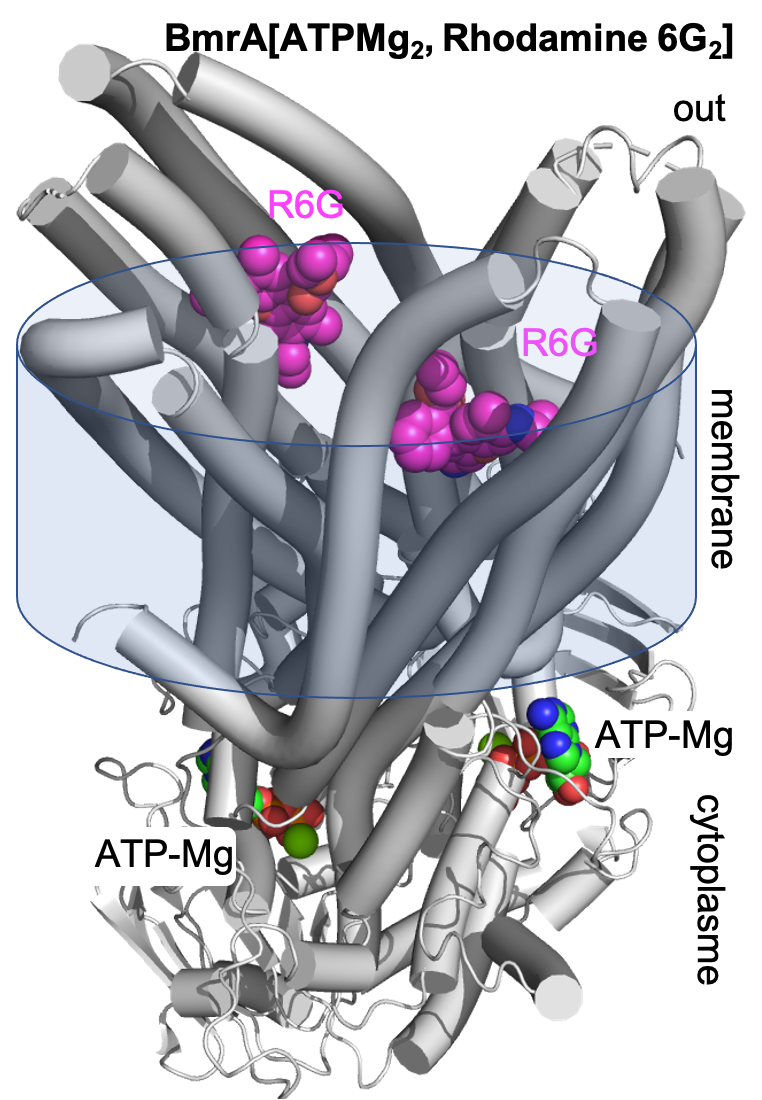
Chaptal V, Zampieri V, Wiseman B, Orelle C, Martin J, Nguyen KA, Gobet A, Di Cesare M, Magnard S, Javed W, Eid J, Kilburg A, Peuchmaur M, Marcoux J, Monticelli L, Hogbom M, Schoehn G, Jault JM, Boumendjel A, Falson P.
Sciences Advances 28 janvier 2022. doi: 10.1126/sciadv.abg9215
Chaptal V, Zampieri V, Wiseman B, Orelle C, Martin J, Nguyen KA, Gobet A, Di Cesare M, Magnard S, Javed W, Eid J, Kilburg A, Peuchmaur M, Marcoux J, Monticelli L, Hogbom M, Schoehn G, Jault JM, Boumendjel A, Falson P.
Sciences Advances 28 janvier 2022. doi: 10.1126/sciadv.abg9215
Contact
Pierre Falson
Chercheur CNRS
Laboratoire de microbiologie moléculaire et biochimie structurale (CNRS/Université Claude Bernard Lyon 1)
Pierre.falson@univ-lyon1.fr
Ahcène Boumendjel
Enseignant chercheur UGA
Laboratoire Radiopharmaceutiques Biocliniques (UGA/Inserm)
ahcene.boumendjel@univ-grenoble-alpes.fr
Chercheur CNRS
Laboratoire de microbiologie moléculaire et biochimie structurale (CNRS/Université Claude Bernard Lyon 1)
Pierre.falson@univ-lyon1.fr
Ahcène Boumendjel
Enseignant chercheur UGA
Laboratoire Radiopharmaceutiques Biocliniques (UGA/Inserm)
ahcene.boumendjel@univ-grenoble-alpes.fr